Periyodik Tablo Nedir ve Özellikleri Nelerdir ?

PERİYODİK TABLO NEDİR?

Elementler, dünyadaki her şeyin yapı taşlarıdır. Sıcaklığa bağlı olarak katı, sıvı veya gaz olabilirler. Çoğu oksijen, altın, bakır, karbon ve helyum gibi elementler doğal olarak oluşur.
Tablodaki her kare bir sayı ve harf içerir. Harfler elementin kimyasal adıdır, örneğin Oksijen O, ancak altın aslında Au'dur. Sayı bir atom numarasıdır.
Atomlar, var olabilecek bir kimyasal elementin en küçük parçacığıdır. Şu anda 118 bilinen element var, ancak bunların sadece 94'ünün Dünya'da doğal olarak var olduğu düşünülüyor.
Periyodik tablo, tüm bu kimyasal elementleri düzenlemenin ve benzerlerini bir araya getirmenin bir yoludur.
Periyodik Tablo, elementleri listelemenin bir yoludur. Elementler, atomlarının yapısına göre tabloda listelenmiştir. Bu, kaç protona sahip olduklarını ve dış kabuklarında kaç elektrona sahip olduklarını içerir. Soldan sağa ve yukarıdan aşağıya, elementler, her atomdaki proton sayısı olan atom numaralarına göre listelenir.
Periyodik tablo neden "periyodik tablo” olarak adlandırılır?

Neden Periyodik Tablo deniyor? "Periyodik" olarak adlandırılır çünkü elementler periyotlar halinde sıralanır. Soldan sağa elementler, atom numaralarına (çekirdeklerindeki protonların sayısına) göre sıralar halinde dizilir. Aynı sayıda valans elektronuna sahip elementlerin aynı sütunlarda sıralanması için bazı sütunlar atlanır. Bu şekilde sıralandıklarında, sütunlardaki öğeler benzer özelliklere sahiptir. Altın için "Au" Latince altın "aurum" kelimesinden gelir.
Kim icat etti?
Periyodik tablo 1869'da Rus kimyager Dimitri Mendeleev tarafından önerildi. Mendeleev, tabloyu kullanarak birçok elementin özelliklerini keşfedilmeden önce doğru bir şekilde tahmin edebildi. Karbon, yaşamın varlığı için önemli elementtir. Fransiyum, dünyadaki en nadir elementtir. Muhtemelen herhangi bir zamanda yeryüzünde birkaç onstan fazla yoktur. Periyodik tabloda bulunmayan tek harf J harfidir. Arjantin ülkesi, Latince argentum olan gümüş elementinden (Ag sembolü) sonra adlandırılmıştır. Yeryüzünde helyum bulunmasına rağmen ilk olarak güneşi gözlemleyerek keşfedilmiştir.
Periyodik tablo, orjinal olarak Mendeleev ve Moseley tarafından geliştirildiğinden bu yana, zaman içinde kapsamlı değişikliklere uğramıştır. Diğerleri yapay olarak sentezlenirken birçok yeni unsur keşfedildi. Periyodik tablo, elementlerin atom numaralarına göre düzenlenmesidir, böylece benzer özelliklere sahip elementler aynı dikey sütun veya grupta görünür.
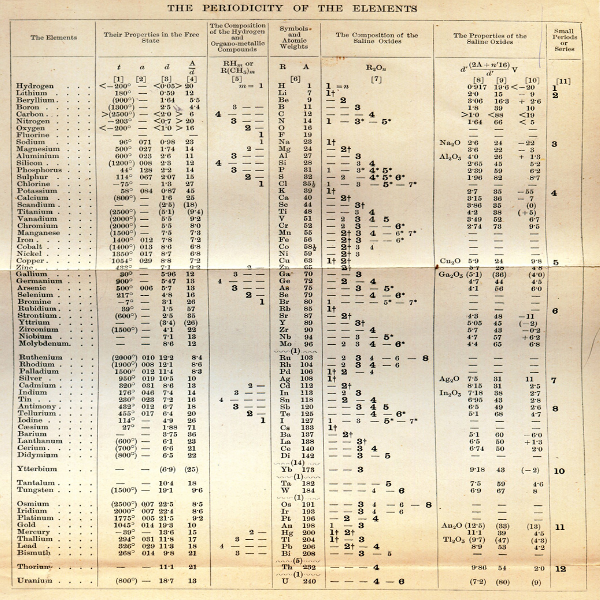
Aşağıdaki şekil, periyodik tablonun en yaygın kullanılan şeklini göstermektedir. Her kare, ismiyle birlikte elementin kimyasal sembolünü gösterir. Sembollerin birçoğunun elementin adıyla ilgisiz göründüğüne dikkat edin: Demir için Fe, Kurşun için Pb, vb. Bunların çoğu, eski zamanlardan beri bilinen ve Latince isimlerine dayanan sembollere sahip unsurlardır. Her elementin atom numarası sembolün üzerine yazılır.

Periyodik Tablo Ne Kadar Uzağa Gidiyor?
"bir disiplin olarak kimyanın tam kalbinde yer alan" Periyodik tabloyu doldurma çabaları, özel görelilik sorularını gündeme getiriyor.
Aralık 2015'e kadar, periyodik tabloda boşluklar vardı, elementler sentezlendi, ancak henüz resmi olarak tanınmadı. Ancak Uluslararası Periyodik Tablo Yılına girerken, klasik periyodik tablo yedinci sırasına kadar dolduruldu: 2015'in sonlarında, Uluslararası Saf ve Uygulamalı Kimya Birliği 113, 115, 117 ve 118 öğelerini resmen onayladı. Yeni elementler ayrıca nihai isimlerini aldı: nihonium, moscovium, tennessine ve oganesson. Sonraki unsurları, 119 ve 120'yi bulma çabaları sürüyor.
Kimyagerler yeni elementleri sentezlerken bu yasa sınırlarını zorlamaktadır. Zaten, atom sayıları her zamankinden daha yüksek hale geldikçe, bazı yeni elementlerin kimyasal özellikleri, aynı gruptaki diğer elementlerinkilere benzemiyor. Scerri, Scientific American için 2013 tarihli bir makalesinde, "bu, tablonun varlığının ardındaki mantığı zayıflatabilir: Periyodik tabloya adını veren yinelenen kalıplar." Tam olarak kaç element keşfedilmeyi bekliyor? Periyodik tablonun bir sonu var mı? Ne zaman ulaşacağız? Bize elementlerin doğası hakkında ne öğretiyor?
Periyodik tablonun 'babası'

Mendeleev, elementleri hem atom ağırlığı hem de valansa göre düzenledi. Henüz keşfedilmemiş elementler için yer bırakmakla kalmadı, aynı zamanda bu elementlerin beşinin ve bileşiklerinin özelliklerini de tahmin etti. 1869'da bulguları Rus Kimya Derneği'ne sundu. Yeni periyodik sistemi Alman kimya dergisi Zeitschrift fϋr Chemie'de (Journal of Chemistry) yayınlandı.
Periyodik tablo muazzam miktarda önemli bilgi içerir:
Atom numarası: Bir atomdaki proton sayısı, o elementin atom numarası olarak adlandırılır. Proton sayısı, hangi element olduğunu ve ayrıca elementin kimyasal davranışını belirler. Örneğin, karbon atomlarının altı protonu, hidrojen atomlarının bir ve oksijen atomlarının sekiz protonu vardır.
Atomik sembol: Atomik sembol (veya element sembolü), bir elementi temsil etmek için seçilen bir kısaltmadır (karbon için "C", hidrojen için "H" ve oksijen için "O", vb.). Bu semboller uluslararası olarak kullanılmaktadır ve bazen beklenmediktir. Örneğin, tungsten için sembol "W" dir, çünkü bu elementin başka bir adı wolfram'dır. Ayrıca, "Au" ise altının atomik sembolü, çünkü Latince altın kelimesi aurum'dur.
Atom ağırlığı: Bir elementin standart atom ağırlığı, elementin atomik kütle birimleri (amu) cinsinden ortalama kütlesidir. Tek tek atomlar her zaman tam sayıdaki atomik kütle birimlerine sahiptir; ancak, periyodik tablodaki atomik kütle, bir elementin çeşitli izotoplarının ortalaması olduğu için ondalık sayı olarak belirtilir. Bir element için ortalama nötron sayısı, atom kütlesinden proton sayısını (atom numarası) çıkararak bulunabilir.
93-118 elementleri için atom ağırlığı: Doğal olarak oluşan elementler için atom ağırlığı, o elementin izotoplarının doğal bolluklarının ağırlıklarının ortalaması alınarak hesaplanır. Bununla birlikte, laboratuvarda oluşturulan trans-uranyum elementler için - atom numarası 92'den yüksek olan elementler - "doğal" bolluk yoktur. Sözleşme, periyodik tabloda en uzun ömürlü izotopun atom ağırlığını listelemektir. Gelecekte daha uzun yarı ömre sahip yeni bir izotop üretilebileceğinden, bu atom ağırlıkları geçici kabul edilmelidir.
Bu kategori içinde süper ağır elementler veya atom numaraları 104'ün üzerinde olanlar vardır. Atomun çekirdeği - içindeki proton sayısı ile artan - ne kadar büyükse, element genel olarak o kadar kararsızdır. Bu nedenle, Uluslararası Saf ve Uygulamalı Kimya Birliği'ne (IUPAC) göre, bu büyük boyutlu elementler, daha hafif elementlere dönüşmeden önce sadece milisaniyeler sürüyor. Örneğin, süper ağır elemanlar 113, 115, 117 ve 118, Aralık 2015'te IUPAC tarafından doğrulandı ve tablodaki yedinci sırayı veya periyodu tamamladı. Birkaç farklı laboratuvar, süper ağır unsurları üretti. Atom numaraları, geçici isimler ve resmi isimler:
113: ununtrium (Uut), nihonyum (Nh)
115: ununpentium (Uup), moscovium (Mc)
117: ununseptium (Uus), tennessine (Ts)
118: ununoktiyum (Uuo), oganesson (Og)
Periyodik Tablonun Tarihi

Dimitri İvanoviç Mendeleyev
Altın, gümüş, kalay, bakır, kurşun ve cıva demir gibi elementler eski çağlardan beri biliniyordu. Bir elementin ilk bilimsel olarak bulunması 1649 yılında Henning Brand'ın fosforu bulmasıyla başlamıştır. Bundan sonraki 200 yıl boyunca elementler ve onların bileşikleri hakkında kimyacılar tarafından pek çok bilgi elde edilmiştir. Bununla beraber 1869 yılına kadar toplam 63 element bulunabilmiştir.
1817 yılında Johann Dobereiner benzer kimyasal özelliklere sahip olan stronsiyum, kalsiyum ve baryuma bakarak, stronsiyumun atom ağırlığının kalsiyum ve baryum atom ağırlıklarının ortasında olduğuna dikkat çekmiştir. 1829 yılında klor, brom ve iyot üçlüsünün de benzer özellikler gösterdiği bulunmuştu. Yine benzer davranış lityum, sodyum ve potasyum için de gözleniyordu. 1829 ve 1858 yılları arasında bu konuda pek çok araştırma yapıldı. Bu sırada halojenler grubu katıldı. Oksijen, kükürt, selenyum ve tellür bir grubun üyesi olarak düşünülürken azot, fosfor, arsenik, antimon ve bizmut başka bir grup içine yerleştirildiler.
İlk periyodik tabloyu oluşturma şerefi Fransız bilim adamı A. E. Beguyer de Chancourtois'e düştü. De Chancourtois, silindirin çevresine 16 kütle birimleri yerleştirerek element ve iyonları buraya oturttu. Benzer özelliklerdeki elementler bu silindir üzerinde düşey satırlarda gruba ayırmıştı. Atom ağırlıkları sekizin katı kadar olan elementlerin özellikleri benzerdi. 1864 yılında yazılan bir yazıda Newlands bunu Oktav kanunu (Law of Octaves) olarak tanımladı. Bu kanuna göre herhangi bir element tablodaki sekizinci elementle benzerlikler gösteriyordu.
Genelde periyodik tablonun babası olarak Alman bilim adamı Julius Lothar Meyer ve Rus bilim adamı Dimitri Mendeleyev kabul edilir. Her ikisi de birbirinden habersiz olarak dikkate değer benzer sonuçlar ürettiler. Mendeleyev atomların artan atom ağırlıklarına göre sıralandıklarında belli özelliklerin tekrarlandığını görmüştür. Daha sonra elementleri tekrarlanan özelliklerine göre alt alta sıralayarak ilk iki periyodu yedişer, sonraki üç periyodu ise on yedişer element içeren bir periyodik sistem hazırlamıştır. Mendeleyev'in hazırladığı periyodik sistemde bazı yerleri henüz keşfedilmemiş elementlerin olduğunu düşünerek boş bırakmıştır. Daha sonra bulunan skandiyum, galyum, germanyum elementleri tablodaki boşluklara yerleşmişlerdir.
1895 yılında Lord Rayleigh, yeni bir soygaz (argon) keşfettiğini bildirdi. Bu element periyodik tabloda bilinen hiçbir yere oturtulamadı. 1898 yılında William Ramsay bu elementin klor ile potasyum arasında bir yere konulabileceğini önerdi. Helyum da aynı grubun bir üyesi olarak düşünüldü. Bu grup elementlerinin değerliklerinin sıfır olması nedeniyle sıfır grubu olarak adlandırıldı.
